Sülfür Tayini
Sülfür bileşikleri çoğunlukla yeraltı sularında ve sıcak kaynak sularında bulunurlar. Sülfür bileşikleri atıksulara, organik maddelerin parçalanmasıyla veya endüstriyel atıklarla karışır. Sülfat bileşiklerinin bakteriyel indirgenmesi sonucunda da suda sülfür bileşikleri oluşur. Sülfür içeren atıksulardan havaya hidrojen sülfür kaçması, çevrede koku problemine neden olur. Temiz sularda hidrojen sülfür’ün (H2S) eşik koku konsantrasyonu 0.025 µg/L ile 0.25 µg/L arasındadır. Hidrojen Sülfür (H2S) çok toksik bir gaz olup kanalizasyonda çalışan işçiler için çok zararlıdır. Sulardaki sülfür bileşikleri metal malzemelere doğrudan, beton kanallara da dolaylı olarak etki saparak ciddi şekilde korozyona neden olurlar.
Sularda, kükürt genellikle hidrojen sülfür (H2S), demir sülfür (FeS) ve yüksek pH’larda sodyum sülfür (Na2S) şeklinde bulunur. Hidrojen sülfür (H2S) normal şartlarda gaz halindedir. Kötü kokulu bir gaz olup sudaki çözünürlüğü az olduğundan konsantrasyonu büyük miktarlara ulaşmaz. Suya hafif asidik özellik verdiğinden korozifliği artırır.
Yeraltı suyundaki sülfürlerin esas kaynağı sülfatlardır. Özellikle oksijensiz ve fazla sülfatlı sularda gelişen sülfat indirgeyici mikroorganizmalar sülfatları hidrojen sülfüre dönüştürür. Böylece oluşan hidrojen sülfür (H2S), demir borularda demiri, demir sülfür’e çevirir. Meydana gelen demir sülfür (FeS), boru içerisinde çökelmek sureti ile boruların tıkanmasına neden olur. Aşağıda hidrojen sülfür ve demir sülfür oluşum reaksiyonları verilmiştir:
CaS04 + C02 + H20 –> CaC03 + H2 + 202
2H2+ 2Fe + 02 –> 2FeS + 2H20
Sularda bulunabilecek sülfür bileşikleri analitik açıdan üç gruba ayrılır:
- Toplam sülfür
- Çözünmüş sülfür
- İyonize olmayan hidrojen sülfür
Toplam sülfür: Toplam sülfür, çözünmüş H2S ve HS’i içerir. pH:12’de çözünmüş sülfürün %0.5’i S– halinde bulunur. pH:11’de ise bu oran %0.05’e kadar iner. Bakır ve gümüş sülfürlerin çözünmesi çok güç olduğundan normal sülfür tayinlerinde pratik olarak ihmal edilebilirler.
Çözünmüş sülfür: Askıda katı maddeler uzaklaştırıldıktan sonra kalan sülfür bileşikleridir.
İyonize olmamış hidrojen sülfür: Numunenin pH’ı, çözünmüş sülfür konsantrasyonu ve H2S’in iyonizasyon sabiti yardımı ile iyonize olmamış hidrojen sülfür konsantrasyonu hesaplanabilir.
Sülfür Analizi İçin Numune Alma ve Saklama
Numuneler, içine minimum miktarda hava girecek şekilde alınmalı ve saklanmalıdır. Numuneleri korumak ve saklamak üzere, numune kabı boş iken içine çinko asetat çözeltisi katılır ve su numunesi bunun üzerine alınır. 100 ml su numunesi için 2N çinko asetat çözeltisinden 4 damla ilave edilir. Daha sonra numune kabı ağzına kadar numune ile doldurulur ve ağzı kapatılır.
Sülfür Deneyi İçin Kalitatif Testler
Analiz edilecek numunede “Sülfür” bulunup bulunmadığını anlamak için aşağıdaki kalitatif metotlardan biri kullanılabilir.
Antimuan testi: 5 mg/L konsantrasyonda sülfür içeren bir numuneye gerekli reaktiflerin ilave edilmesiyle sarı renkli antimuan sülfür (Sb2S3) oluşumu gözlenir.
Gümüş-gümüş sülfür elektrot testi: Referans bir elektroda bağlı gümüş-gümüş sülfür elektrodunun potansiyeli, çözeltideki sülfür iyonunun aktivitesi ile değişir. İyon aktivite katsayısı ve pil için düzeltme yapılarak bu potansiyelden yaklaşık sülfür konsantrasyonu tahmin edilir. Elektrot, zaman zaman bilinen konsantrasyonda bir sülfür standart çözeltisine karşı standardize edilmelidir. Bu tip bir elektrot gümüş veya kurşun tuzunun standart bir çözeltisi ile, çözünmüş sülfürün titrasyonunda dönüm noktası indikatörü olarak kullanılabilir.
Kurşun asetat kağıdı ve gümüş folye testleri: Kokulu numunelerde kurşun asetat kağıdı ile H2S tespit edilir. Kağıt biraz asitlendirilmiş bir numunenin buharına maruz kaldığında PbS’ün oluşması nedeni ile siyahlaşır. Bir parça gümüş folye şeridi, kurşun asetat kağıdından daha hassastır. Gümüş, NaCN çözeltisine daldırılarak temizlenir ve durulanır. Siyah Ag2S havada yavaşça oksitlenen PbS’den daha kalıcı olduğundan, muhtemel H2S kaynaklarının çevresinde, özellikle uzun süreli maruz kalmalar için gümüş folyenin kullanılması daha uygundur.
Sülfür Tayini İçin Metot Seçimi
Asidik çözeltide iyot, sülfür ile reaksiyona girerek onu kükürde oksitler. Bu reaksiyona dayanan titrasyon, eğer girişimler yoksa ve numuneden H2S kaybı engellenirse, 1 mg/L’nin üzerindeki sülfür konsantrasyonlarını belirlemek üzere hassas bir tayin metodudur. İyodometrik metot, metilen mavisi kolorimetrik metodunu standardize etmek üzere uygundur. Bu metot, kuyulardan ve kaynaklardan taze olarak alınan su numunelerinin analizi için uygundur. Girişim yapan maddeler önceden uzaklaştırılırsa, bu metot kükürtlü kaynak sularında ve atıksularda sülfür tayini için kullanılabilir.
Metilen mavisi metodu; sülfür, ferri klorür ve dimetilp fenilendiamin arasındaki reaksiyona dayanır. Renk gelişiminden sonra ferri klorürün rengini uzaklaştırmak üzere amonyum fosfat ilave edilir. İşlem sadece 20 mg/L sülfür konsantrasyonlarına kadar geçerlidir.
Gümüş elektrodun kullanıldığı potansiyometrik metotlar, sularda sülfür tayini için uygundurlar. Elektrot özellikle gümüş nitrat ile çözünmüş sülfürün titrasyonunda bir dönüm noktası indikatörü olarak kullanılabilir. Bu metotta iyi sonuç alabilmek için deney işlemlerine çok dikkat edilmesi ve sık sık standardizasyon yapılması gerekir.
Çözünmüş ve Çözünmemiş Sülfürlerin Ayrılması: Numunedeki çözünmüş sülfürü ölçebilmek için suda askıda katı maddenin bulunmaması gerekir. Bu amaçla, alüminyum hidroksit yumakları oluşturup çöktürülür. Böylece elde edilen üst sıvıdan numune alınarak sülfür tayini yapılır.
Gerekli Araç ve Gereçler
- Kapaklı cam şişeler: Metilen mavisi metodu ile sülfür tayini için 100 ml’lik ağzı kapaklı cam kaplar gereklidir. İyodometrik metot ile tayinde 500 ve 1000 ml’lik ağzı kapaklı cam şişeler kullanılır.
Gerekli Reaktifler
- Sodyum hidroksit çözeltisi (NaOH), 6 N
- Alüminyum klorür çözeltisi, 6 N: Higroskobik özelliği ve kekleşme eğilimi nedeniyle bu kimyasal madde 100 gr’lık şişeler halinde satın alınır. 100 gr’lık şişe açılıp, içindekileri 144 ml destile suda çözmek suretiyle alüminyum klorür çözeltisi hazırlanır.
Sülfür Deneyinin Yapılışı
100 ml’lik cam şişe numune ile doldurulur. 0.2 ml (4 damla) NaOH ve 0.2 ml alüminyum klorür ilave edilir. Şişe hava almayacak şekilde sıkıca kapatılır ve çalkalamak suretiyle 1 dakika karıştırılır. Bu kimyasal maddeler ilave edildikten sonra iyi bir saflaştırma sağlanır. Eğer 500 ml’lik veya 1000 ml’lik şişeler kullanılıyorsa, bununla orantılı olarak reaktif maddeler ilave edilmelidir. Daha sonra berrak bir çıkış suyu elde edilene kadar çökelmeye bırakılır. İyi bir yumaklaştırmadan sonra çöktürme işlemi 5-15 dakika sürer.
Numunelerin Ön Arıtımı: iyodometrik metoda, iyot ile reaksiyona giren tiyosülfat, sülfit ve çeşitli organik bileşikler gibi indirgen maddeler girişim etkisi yaparlar. Kuvvetli indirgen maddeler mavi rengin oluşumunu engelleyerek metilen mavisi testine girişim yaparlar. 10 mg/L’nin üzerindeki tiyosülfat konsantrasyonları renk oluşumunu geciktirebilir veya tamamen engelleyebilir.
Numunedeki sülfür konsantrasyonu çok yüksekse, sülfürün kendisi de reaksiyona girişim yapabilir. Su numunesinde hatalı negatif sonuçların elde edilmesini önlemek için numunedeki sülfür konsantrasyonunun birkaç yüz mg/L mertebesinde olması gerekir. Hatalı negatif sonuçlardan sakınmak üzere antimon metodu kullanılır. İyodür, petrol atıksularında bulunabilir ve 2 mg/L konsantrasyondan daha fazla ise renk oluşumunu azaltabilir.
Sülfit, tiyosülfat, iyodür ve pekçok diğer çözünebilir maddenin girişimleri giderilebilir, ancak ferrosiyanürünki giderilemez. Numunedeki sülfürler önce ZnS halinde çöktürülüp, daha sonra üst sıvı uzaklaştırılır, yerine destile su ilave edilir. Aynı işlem kullanılarak sülfürler derişik hale getirilir.
Araç ve Gereç
- Kapaklı cam şişeler gereklidir.
Reaktifler
- Çinko asetat çözeltisi, 2 N: 220 gram Zn(C2H3O2)2.2H20, 870 ml destile suda çözülerek 1 litreye tamamlanır.
- Sodyum hidroksit çözeltisi NaOH, 6 N
Ön Arıtma İşlemi
a) 100 ml’lik cam şişeye 0.15 ml (3 damla) 2N çinko asetat çözeltisi ve 0.1 ml (2 damla) 6 N NaOH çözeltisi katılır. Hava kabarcığı kalmayacak şekilde kapatılır ve şiddetle ileri geri sallayarak karıştırılır. İyodometrik işlem için 500 ml veya daha uygun büyüklükte bir şişe kullanılmalıdır. Amaç, suyunu kolayca bırakabilen ve şişkin olmayan bir çökelek elde etmek olduğu için, numune özelliğine bağlı olarak çeşitli hacimlerde reaktif eklenir. Numuneye pH: 9.0’a ayarlamak üzere yeterli miktarda NaOH ilave edilir, 30 dakika çökelmeye bırakılır. Arıtılmış numune oldukça dayanıklı olup, saatler mertebesinde bekletilmesinin sakıncası yoktur.b)Eğer sülfür tayini için iyodometrik metot kullanılacaksa, çökelek cam yünü filtre kağıdından süzülür ve daha sonra titrasyon işlemi uygulanarak metot tamamlanır. Eğer metilen mavisi metodu kullanılacaksa, çökelme için 30 dakika beklenir ve üst sıvısı ayrılır. Numune şişesi yeniden destile su ile doldurulur, çökelek yeniden askıda hale getirilir. Eğer girişim yapan maddeler yüksek konsantrasyonlarda bulunuyorsa, çökeltim, dekantasyon ve yeniden doldurma gibi işlemler uygulanır. Eğer sülfür konsantrasyonları düşük seviyede ise, numuneye yeterli miktarda su ilave edilerek hacimce yarı yarıya veya orijinal hacmin 1/5’ine ayarlama yapılır. Bu tekniği çok küçük sülfür konsantrasyonları içeren numunelerin analizi için kullanmak mümkündür. Sülfür konsantrasyonu kolorimetrik olarak belirlendikten sonra elde edilen sonuç, final ve başlangıçtaki numune hacimleri dikkate alınarak düzeltilmelidir. Bazen kadmiyum tuzları çinko yerine çöktürme amacı ile kullanılır. Ancak CdS, ZnS’e kıyasla oksidasyona çok daha uygun durumdadır.
Sülfür Tayini İçin İyodometrik Metot
Reaktifler
- Hidroklorik asit (HCl) 6 N
- Standart iyot çözeltisi, 0.025 N: 20-25 gr Kl ve 3.2 gr I2 destile suda çözülür. İyot tamamen çözündükten sonra 1000 ml’ye seyreltilir ve 0.025 N Na2S2O3‘e karşı standardize edilir.
- Standart sodyum tiyosülfat çözeltisi, 0.025 N: 6.205 gr Na2S2O3.5H20 destile suda çözülür. 1.5 ml 6 N NaOH veya 0.4 gr NaOH ilave edilir ve 1000 ml’ye seyreltilir. Bu çözelti, biiyodat çözeltisi ile standardize edilir.
- Nişasta çözeltisi: Sulu çözelti hazırlamak için 2 gr laboratuvar saflığında çözünür nişasta ve 0.2 gr salisilik asit 100 ml sıcak destile suda çözülür.
Sülfür Deneyinin Yapılışı
500 ml’lik erlenmayere belli hacimde su numunesi ölçülerek ilave edilir. Gerekirse destile su da eklenebilir. İlave edilebilecek destile su hacmi 20 ml kadar olabilir. Pipetle 200 ml numune alınır, erlenmayere konur. Üzerine 2 ml 6 N HCI katılır. İçine bir miktar iyot konur. Eğer numunenin içinde iyodun rengi kaybolursa, bir miktar daha iyot ilave edilir. Bu işleme kalıcı renk elde edilinceye kadar devam edilmelidir. Birkaç damla nişasta indikatörü ilavesinden sonra Na2S2O3 çözeltisi ile geri titre edilir. Titrasyon işlemi mavi rengin kaybolduğu dönüm noktasına kadar devam eder. Eğer sülfür çinko ile çöktürülürse, oluşan çinko sülfür (ZnS) filtrelenir, uzaklaştırılır. 20 ml destile su ve iyot çözeltisi ilave edildikten sonra titrasyon yapılır.
Sülfür Deney Sonucunun Hesabı
1 ml 0.025 N iyot çözeltisi, 0.4 mg sülfürle reaksiyona girer.
mg S–/l = [(A x B) – (C x D)] x 16000 / ml numune
Burada;
A : İyot çözeltisi (ml)
B : İyot çözeltisinin normalitesi
C : Sodyum tiyosülfat çözeltisi (ml)
D : Na2S2O3 çözeltisinin normalitesidir.
Metodun Hassasiyeti
Dönüm noktasının doğruluğu numuneye bağlı olarak değişir. Temiz sularda 1 damla ile dönüm noktasına ulaşılabilir. 1 damla titrant, 200 ml numunede 0.1 mg/L sülfüre eşdeğerdir.
İyonize Olmamış Hidrojen Sülfürün Hesabı
Hidrojen sülfür ve HS–, birlikte çözünmüş sülfürü teşkil ederler ve hidrojen iyonları ile denge halindedirler;
H2S –> HS– + H+
H2S’in iyonizasyon sabiti çözünmüş sülfürün bu iki tür arasındaki dağılımını hesaplamak üzere kullanılır. Bu sabit logaritmik formda, pK olarak kullanılır. İyonizasyon sabiti sıcaklıkla ve çözeltinin iyon şiddeti ile değişir. İyon şiddetinin etkisi, iletkenlikten yararlanarak kolayca tahmin edilebilir. İyon şiddetinin etkisi pek fazla olmadığından, eğer numunenin tabiatı biliniyorsa, pK değerleri sıcaklığa bağlı olarak tahmin edilebilir.
Aşağıdaki tabloda çeşitli sıcaklık ve iletkenlik değerleri için pK değerleri verilmektedir. Sıcaklığın etkisi 15°C’den 35°C’ye kadar pratik olarak lineer olduğundan, bu aralıkta interpolasyon veya ekstrapolasyon yapılabilir.
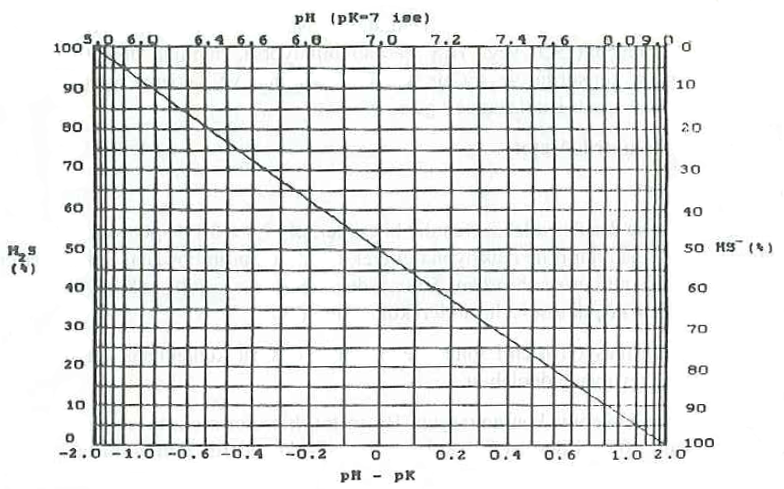
Aşağıdaki tablonun son satırında verilen özellikler, yaklaşık olarak deniz suyuna uymaktadır. Su numunesinin pH değeri ve pK’değeri yardımıyla pH-pK’ hesaplanır. Aşağıdaki şekilden, soldaki skaladan çözünmüş sülfürün H2S olarak bulunan kesri okunur. Buna J denirse, iyonize olmamış H2S aşağıdaki formülden hesaplanır;
J x (Çözünmüş sülfür) : S cinsinden iyonize olmamış H2S miktarı
Hidrojen sülfür için iyonizasyon sabitlerinin logaritmik değerleri (pK’)
| 25°C’deki iletkenlik (µmho/cm | Verilen sıcaklıktaki pK’ değeri | ||
| 20°C | 25°C | 30°C | |
| 0 | – | 7.03 | – |
| 100 | 7.08 | 7.01 | 6.94 |
| 200 | 7.07 | 7.00 | 6.93 |
| 400 | 7.06 | 6.99 | 6.92 |
| 700 | 7.05 | 6.98 | 6.91 |
| 1200 | 7.04 | 6.97 | 6.90 |
| 2000 | 7.03 | 6.96 | 6.89 |
| 3000 | 7.02 | 6.95 | 6.88 |
| 4000 | 7.01 | 6.94 | 6.87 |
| 5200 | 7.00 | 6.93 | 6.86 |
| 7200 | 6.99 | 6.92 | 6.85 |
| 10000 | 6.98 | 6.91 | 6.84 |
| 14000 | 6.97 | 6.90 | 6.83 |
| 22000 | 6.96 | 6.89 | 6.82 |
| 50000 | 6.95 | 6.88 | 6.81 |